1. INTRODUCCIÓN El agua es el compuesto más importante de la Naturaleza. El agua desempeña un papel crucial en una serie de procesos físicos, químicos y biológicos. Al mismo tiempo, su cantidad y calidad, incluida su distribución espacial y temporal, tocan todas las esferas de la actividad humana. El estudio del agua continúa involucrando a profesionales en una variedad de campos, incluyendo ingeniería, física, química, biología, geología, geografía, sociología y derecho, por nombrar algunos de los más importantes (Figura 1). En consecuencia, es una necesidad absoluta que los profesionales comprendan el agua y sus propiedades, de modo que su administración y gestión se puedan hacer de manera racional.
La estructura de la molécula de agua parece bastante simple, pero una caracterización completa continúa siendo un desafío para los científicos. Es necesario un estudio sistemático del agua, en forma molecular y en conjunto, para arrojar luz adicional sobre sus capacidades y usos, y para comprender por qué es el compuesto químico elegido por la Naturaleza para acondicionar y apoyar la vida. Las propiedades más destacadas del agua son las siguientes:
En este artículo exploramos las propiedades del agua con el objetivo de mejorar su gestión.
2. LOS PIONEROS DE LA CIENCIA DEL AGUA El químico francés Antoine Lavoisier (1743-1794) descubrió que el agua está compuesta por dos elementos: Oxígeno e hidrógeno. Lavoisier reconoció el nombre "oxígeno" en 1778 e "hidrógeno" en 1783. Le dio al hidrógeno su nombre, que significa generador de agua. En 1804, otro químico francés, Joseph Gay-Lussac (1778-1850), junto con el naturalista alemán Alexander von Humboldt (1769-1859), demostraron que la molécula de agua consta de dos átomos de hidrógeno por cada átomo de oxígeno, para formar la omnipresente fórmula química H2O (Fig. 4).
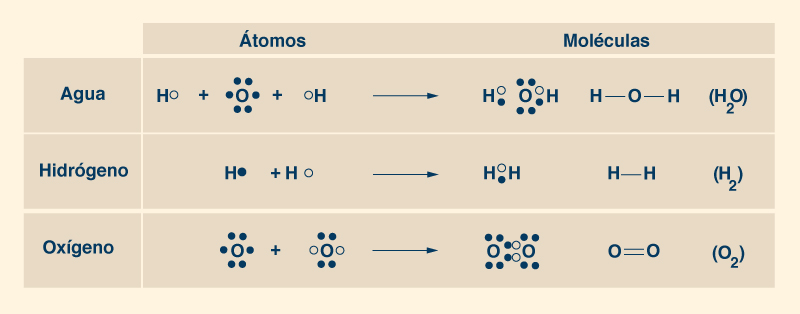
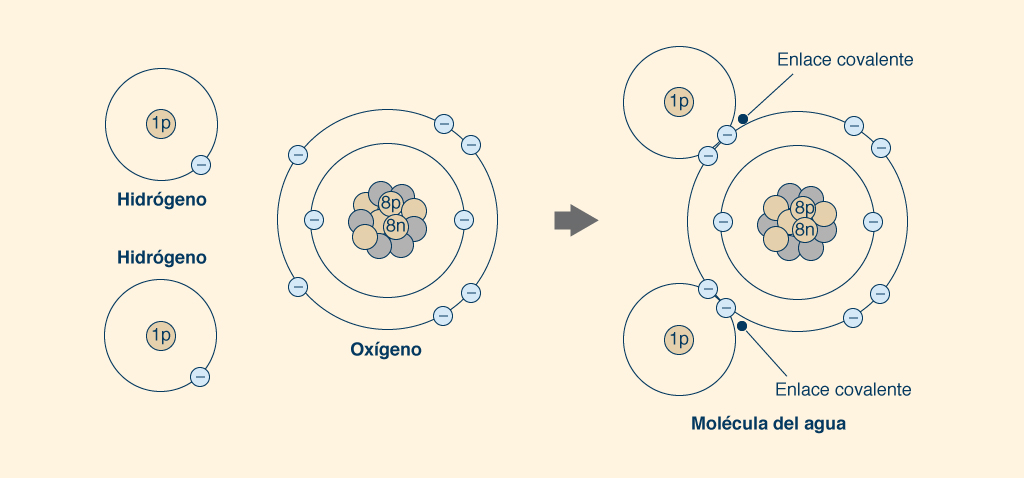
3. LA MOLÉCULA DE AGUA Los átomos de agua se mantienen unidos al compartir sus electrones, las partículas subatómicas cargadas negativamente que rodean el núcleo cargado positivamente. El núcleo de cada átomo de hidrógeno (H), el elemento más pequeño de la Naturaleza, contiene un protón (una partícula subatómica de carga positiva) y un neutrón (una partícula subatómica sin carga eléctrica), y está orbitado por un electrón en una capa única, la cual puede admitir un máximo de dos. Así, un átomo de hidrógeno puede tomar un electrón más en su única capa, la cual participa en el intercambio de electrones con otro átomo de hidrógeno para formar la molécula de H2 (Fig. 5).
Un átomo de oxígeno (O) tiene ocho (8) protones y ocho (8) neutrones en su núcleo, además de ocho (8) electrones orbitando alrededor de él, dos de los cuales (2) están ubicados en una capa interna completa y los otros seis ( 6) en una capa externa incompleta, el cual permite hasta ocho (8) electrones. Por lo tanto, un átomo de oxígeno puede tomar dos electrones más en su capa exterior, el cual participa en el intercambio de electrones con otro átomo de oxígeno para formar la molécula de oxígeno O2 (Fig. 5). Los pares de electrones compartidos forman enlaces covalentes (representados gráficamente con una línea como ésta ___), los cuales proporcionan una atracción más fuerte entre átomos, constituyendo moléculas muy estables. Para formar una molécula de agua (H2O), un átomo de oxígeno se une a dos átomos de hidrógeno, procediendo a compartir sus electrones. Cada uno de los dos átomos de hidrógeno comparte su único electrón con el átomo de oxígeno en su capa exterior, para llenar los dos espacios vacíos, completando así la capa con ocho (8) electrones, mientras se forman dos enlaces covalentes (Fig. 6). De esta manera, cada átomo de hidrógeno está lleno de dos electrones en su capa única y cada átomo de oxígeno está lleno de ocho electrones en su capa exterior. Los dos fuertes enlaces covalentes (entre el átomo de O y los dos átomos de H) mantienen unida a la molécula.
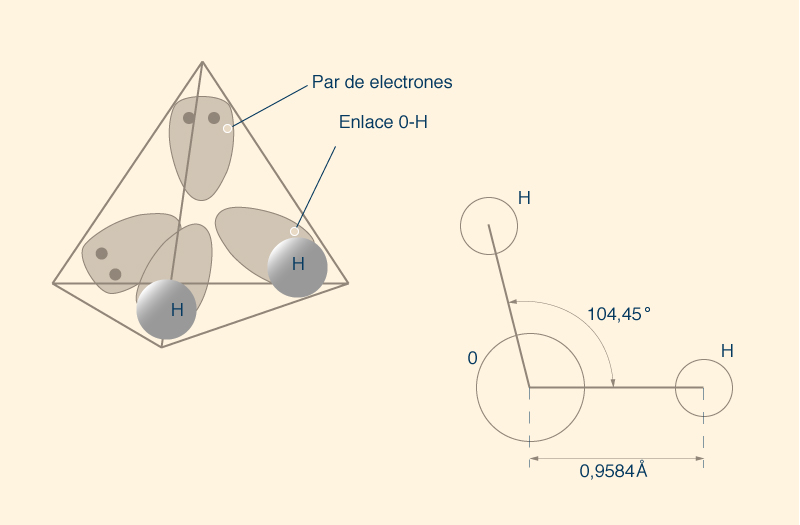
Una molécula de agua tiene dos pares de electrones compartidos, es decir, dos enlaces covalentes simples (H __ O __ H) (Fig. 6). Hay que tomar en cuenta que el ángulo entre los enlaces (O __ H) no es de 180° o 90°, como debería ser si la distribución espacial fuera plana, es decir, bidimensional. Más bien, la molécula de agua tiene una estructura tridimensional, con sus componentes dispuestos siguiendo una geometría molecular tetraédrica (Fig. 7).
Si el tetraedro fuera regular, el ángulo entre los enlaces sería de 109,5°; sin embargo, el tetraedro de la molécula de agua no es regular. El átomo de oxígeno ocupa el centro del tetraedro y los dos átomos de hidrógeno ocupan cada uno de los dos vértices, y los dos vértices restantes albergan los dos pares de electrones de oxígeno que no forman parte de los enlaces covalentes, constituyendo dos nubes de electrones (Fig. 7) . Esta configuración tridimensional da como resultado un tetraedro ligeramente irregular, con un ángulo de 104,5° entre los dos enlaces covalentes que unen el átomo de oxígeno con los dos átomos de hidrógeno.
4. REGULACIÓN DE TEMPERATURA El rango en el que el agua está en estado líquido (0 a 100 ° C a 1 atmósfera de presión ambiental) es ideal para las diversas formas de vida que están presentes en la Tierra. Sin embargo, cuando se compara con compuestos similares, el agua debe hervir a una temperatura inferior a -59°C, no a 100°C. La Tabla 1 contiene los valores de masa molar y punto de ebullición para varios compuestos químicos etiquetados H2X, en el cual X representa los elementos ubicados en la misma columna que el oxígeno en la Tabla Periódica de los Elementos (Fig. 8). [La masa molar M, en g/mol, se define como la masa, en gramos, de una sustancia dada dividida por su cantidad, en moles]. Dado que el agua tiene la masa molar más baja entre estos compuestos, la expectativa es que tenga el punto de ebullición más bajo, no el más alto.
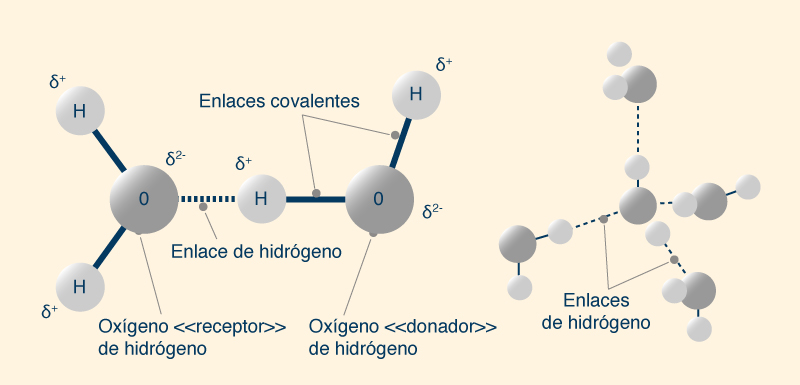
La aparente anomalía puede explicarse por el enlace entre las moléculas de agua, o enlace de hidrógeno. En una molécula de agua, el núcleo de oxígeno con ocho cargas positivas (8+) atrae electrones mejor que el núcleo de hidrógeno con una carga positiva (+1). Por tanto, el átomo de oxígeno está parcialmente cargado negativamente (δ2-) y el átomo de hidrógeno está parcialmente cargado positivamente (δ+). Los átomos de hidrógeno no solo están fuertemente unidos a los átomos de oxígeno por enlaces covalentes, sino que también son atraídos débilmente por otros átomos de oxígeno cercanos por enlaces de hidrógeno. Cada molécula de agua puede "donar" hasta dos hidrógenos y "aceptar" otros dos, en una estructura tetraédrica (Fig. 9).
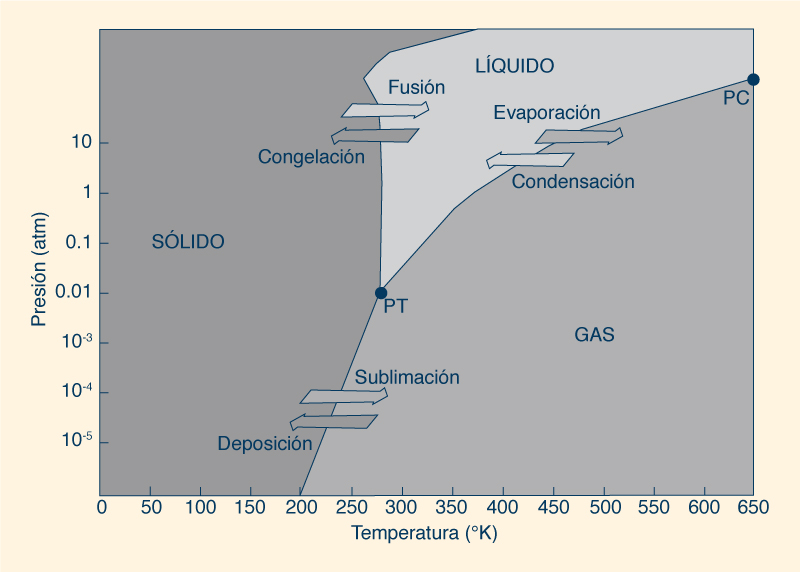
El enlace de hidrógeno es un enlace débil, con una vida útil muy corta. El enlace de hidrógeno roto, sin embargo, a menudo simplemente se reforma, rompiéndose durante períodos de tiempo muy cortos, menos de 100 fentosegundos (1 fentosegundo = 10-15 segundos). En estado sólido (hielo), todas las moléculas de agua participan en cuatro enlaces de hidrógeno (dos como donantes y dos como aceptores) y se mantienen en un estado relativamente estático. En el agua líquida, algunos de los enlaces de hidrógeno más débiles se rompen para permitir que las moléculas se muevan. Esto continúa sucediendo con un aumento de temperatura hasta el punto de ebullición. La gran cantidad de energía necesaria para romper estos enlaces debe suministrarse durante los procesos de fusión y ebullición. Las moléculas de H2Te, H2Se y H2S exhiben fuerzas intermoleculares dipolo-dipolo, que son fuerzas de atracción entre el extremo positivo de una molécula polar y el extremo negativo de otra, formando un enlace que es más débil que un enlace de hidrógeno. En resumen, un enlace de hidrógeno aumenta la cohesión intermolecular, lo que evita que las moléculas de agua se liberen fácilmente de la superficie del agua; en consecuencia, se reduce la presión de vapor. Como la ebullición no puede ocurrir hasta que la presión de vapor sea igual a la presión externa, se requiere una temperatura más alta. El punto de ebullición del agua es función de la presión ambiental. Por ejemplo, en la cima del monte Everest, a una altura de 8848 m, el agua hierve a 70°C, mientras que en las profundidades del mar permanece líquida por encima de los 300°C. Para comprender este comportamiento, debemos examinar la relación entre temperatura y presión.
La movilidad de una molécula de agua aumenta con la temperatura y disminuye con la presión.
La Figura 10 muestra un diagrama de fases que ilustra los estados físicos preferidos del agua a diferentes rangos de temperatura y presión. En PT, o punto triple, las tres fases estables (sólida, líquida y gaseosa) pueden coexistir en equilibrio. Por otro lado, en PC, o punto crítico, las propiedades de las fases líquida y gaseosa se vuelven indistinguibles entre sí. Bajo temperatura y presión suficientemente altas, el agua líquida está lo suficientemente caliente y el agua gaseosa está bajo suficiente presión para que sus densidades sean iguales.
El cambio de agua, de fase líquida a gaseosa, se produce
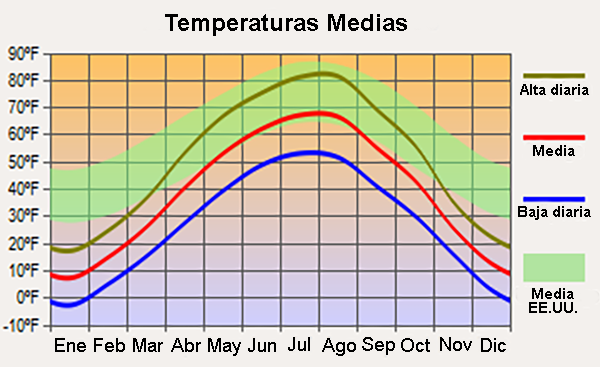
con la absorción de energía (gasto). El agua tiene la capacidad calorífica específica más alta de todos los líquidos (excepto el amoníaco) porque se requiere una gran cantidad de energía para romper los enlaces de hidrógeno (Tabla 2). Dado que la energía absorbida en este proceso no está disponible para aumentar la energía cinética del agua, se necesita una gran cantidad de calor para elevar la temperatura del agua. Además, se necesita una gran cantidad de energía para cambiar el agua de estado líquido a gaseoso, debido a la energía necesaria para romper los enlaces de hidrógeno. En consecuencia, el agua tiene el calor de vaporización más alto de cualquier líquido y, por lo tanto, una volatilidad muy baja (Tabla 2). Esta propiedad del agua es importante para la regulación del clima regional, lo que explica la marcada diferencia entre los climas hiperoceánico y continental interior. Por ejemplo, el estado de Dakota del Norte, EE.UU., con un clima continental interior, está sujeto a una mayor variabilidad de temperatura entre el invierno y el verano que todo el promedio de los Estados Unidos, el cual está influenciado por climas hiperoceánicos (Fig. 11).
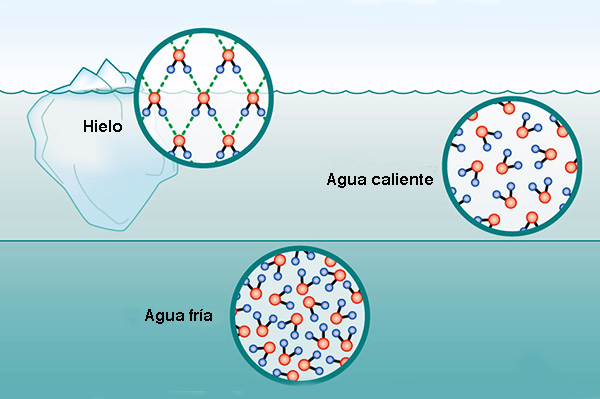
5. FLOTABILIDAD DEL HIELO La densidad del agua varía con la temperatura dentro de un rango muy estrecho (Tabla 3). Normalmente, las sustancias líquidas se encogen con una disminución de la temperatura, lo que aumenta sus densidades. Sin embargo, el agua líquida presenta un comportamiento singular, contrayéndose con la reducción de temperatura hasta que la temperatura alcanza los 4°C. En este punto, el agua alcanza la densidad máxima de 1 g/cm3, después de lo cual comienza a expandirse, disminuyendo su densidad y permitiendo que flote su forma sólida (hielo).
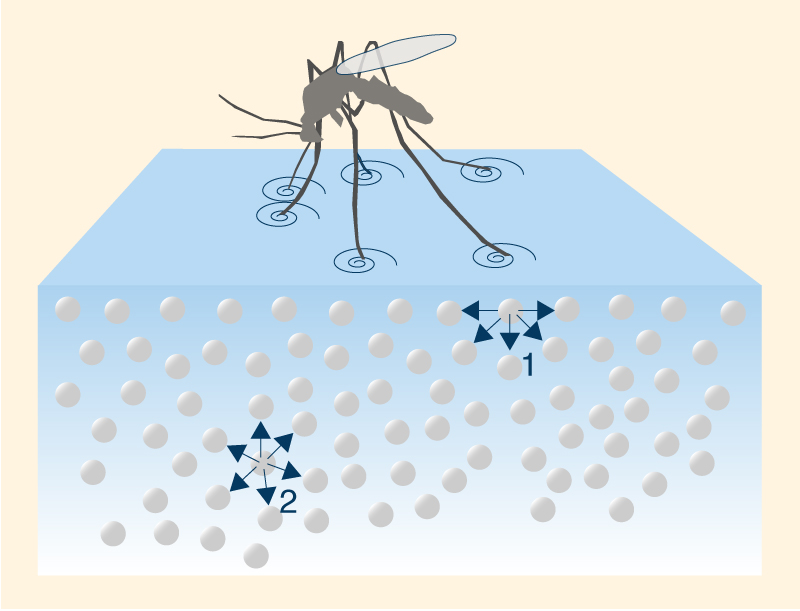
La mayor densidad a 4°C puede explicarse analizando la estructura del hielo. Las moléculas de H2O forman una cuadrícula hexagonal de geometría tetraédrica (Fig. 2). Esta configuración asegura que las moléculas de hielo estén menos compactadas que las moléculas de agua, ocupando un mayor volumen. Así, el enfriamiento a 4°C da como resultado la expansión del espacio entre las moléculas de agua, disminuyendo su densidad. En la Naturaleza, el cambio en la densidad del agua con una temperatura de 4°C o cerca de ella es responsable de la estratificación térmica de la columna de agua. En ausencia de mezcla, a 4°C la capa superior se enfriará hasta el punto de congelación y se formará hielo en la superficie. Esta capa de hielo bloqueará el intercambio de energía entre el aire frío de arriba y el agua caliente de abajo; por lo tanto, el enfriamiento ambiental continúa, pero sin caída de temperatura de la columna de agua debajo. La formación de una capa de hielo en la superficie del cuerpo de agua desalienta la congelación de la columna de agua; por tanto, posibilita la supervivencia de plantas y animales acuáticos en lagos y océanos. 6. TENSIÓN SUPERFICIAL Y CAPILARIDAD Debido a las altas fuerzas cohesivas, las moléculas de agua en la superficie se sienten más atraídas por las moléculas dentro del líquido que por las moléculas (de aire) fuera de él, lo que produce tensión superficial en la entrefase gaseosa-líquida. Por el contrario, las moléculas de agua dentro del líquido son igualmente atraídas en todas direcciones. Esta propiedad hace que sea más difícil mover un objeto a través de la superficie que moverlo cuando está completamente sumergido. Es por eso que los insectos, que son más pesados que el agua, pueden flotar y deslizarse sobre la superficie del agua (Fig. 12).
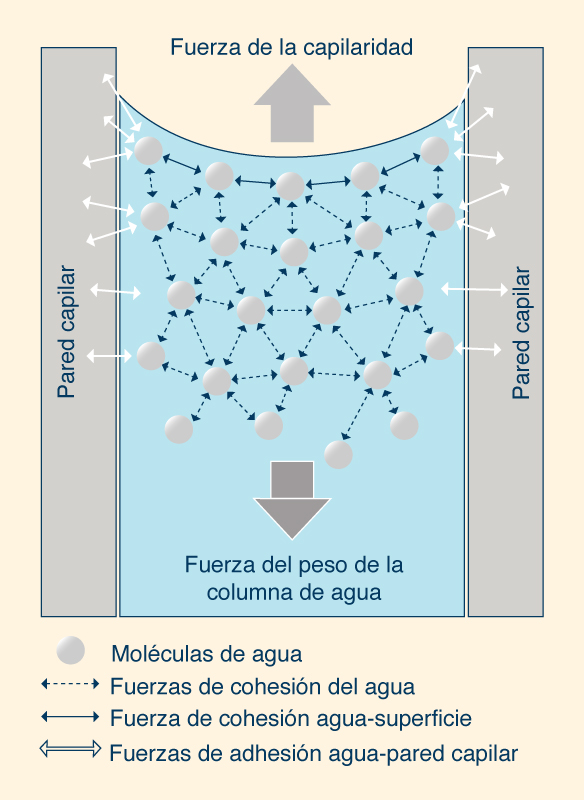
El movimiento del agua hacia arriba o hacia abajo de los tubos capilares se debe a la tensión superficial. La acción capilar ocurre cuando la adhesión de las moléculas de agua a las paredes es más fuerte que las fuerzas cohesivas entre las moléculas líquidas. El menisco es la superficie curva de contacto líquido-gaseoso; la superficie es cóncava cuando las moléculas de líquido son fuertemente atraídas (por adhesión) a las paredes del recipiente, como en el caso del agua (Fig. 13). Por el contrario, el menisco es convexo cuando las moléculas líquidas tienen una atracción más fuerte entre sí (debido a la cohesión) que hacia la pared del recipiente, como ocurre con el mercurio.
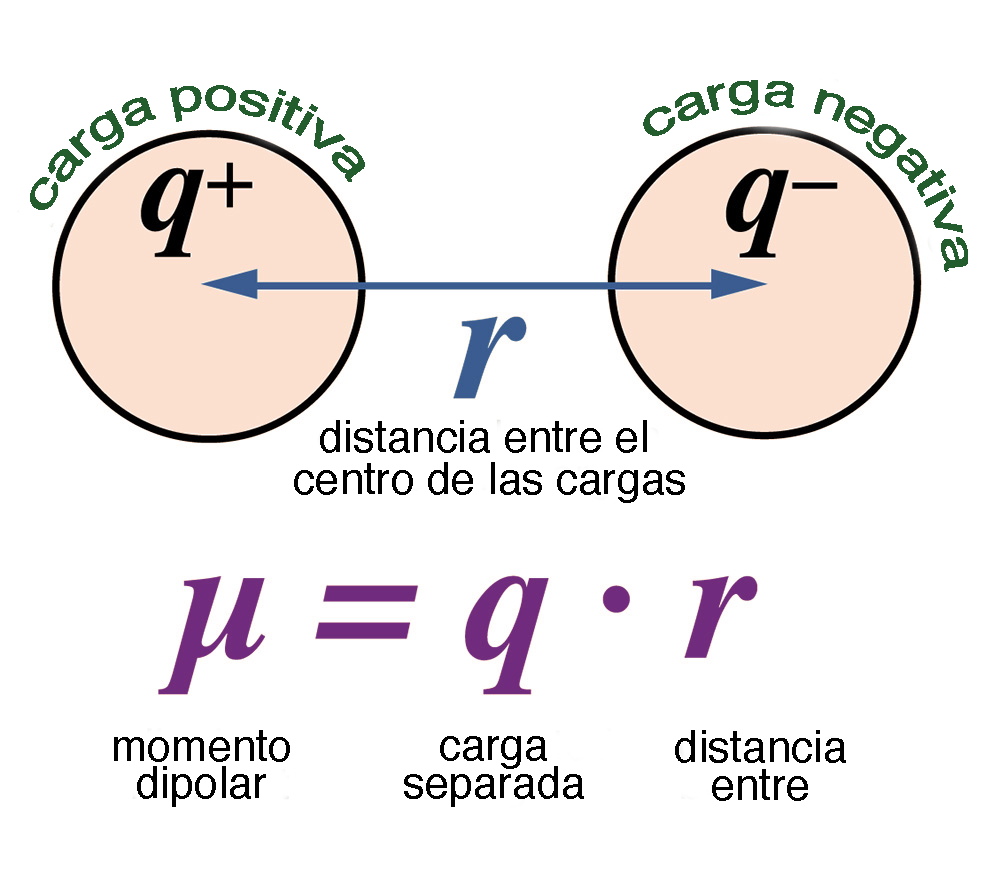
La acción capilar hace posible que las plantas prosperen. La capilaridad permite que el agua subterránea se mueva hacia la zona de las raíces, pero sólo hasta una pequeña distancia, después de la cual no puede vencer la gravedad. Debido a las fuertes fuerzas de cohesión, las moléculas de agua que se evaporan en la superficie de la hoja atraen a otras en el vecindario, lo que ayuda a que el agua suba por la planta y finalmente llegue a todas las ramas. Dentro del perfil del suelo, la altura capilar es de 2 a 5 cm en arena gruesa, aumentando a medida que disminuye el diámetro de las partículas del suelo, llegando a más de 3 a 4 m en algunos casos. 7. POLARIDAD Y PROPIEDADES SOLVENTES La molécula de agua tiene la propiedad de polaridad, presentando un momento dipolar relativamente grande (Fig. 14). El momento dipolar surge porque el oxígeno tiene una carga más negativa que el hidrógeno; por tanto, el oxígeno atrae los electrones compartidos, aumentando la densidad de electrones a su alrededor. El momento dipolar del agua es μ = 1.85 D, en el cual D significa debye, con D = 10-18 estatoculombios-centímetro.
La polaridad del agua es importante para muchas de sus propiedades, incluida la capacidad de disolver solutos, puntos de fusión y ebullición, calor específico, tensión superficial y reactividad general. El agua puede disolver casi cualquier material y, por tanto, se le considera el disolvente universal.
El gran momento dipolar del agua está asociado con su constante dielétrica relativamente alta.
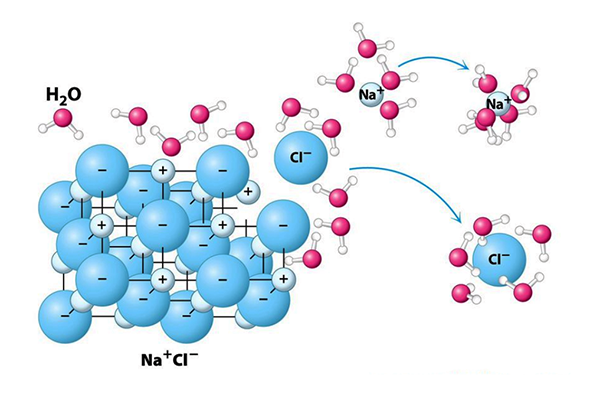
En el vacío, k = 1; para el agua, k = 78,5 (Tabla 4). Este gran valor de k, derivado de la polaridad de la molécula de agua, hace posible que las sustancias formadas por la asociación de dos componentes cargados (más notablemente, el cloruro de sodio) se disocien fácilmente en el agua y que todas las sustancias polares vean su fuerzas de atracción y repulsión disminuidas. Además, la presencia de iones disueltos en el agua da como resultado un marcado aumento de su conductividad eléctrica; de otro modo, el agua se comportaría esencialmente como un medio no conductor debido a la obvia falta de iones nativos en su estado puro.
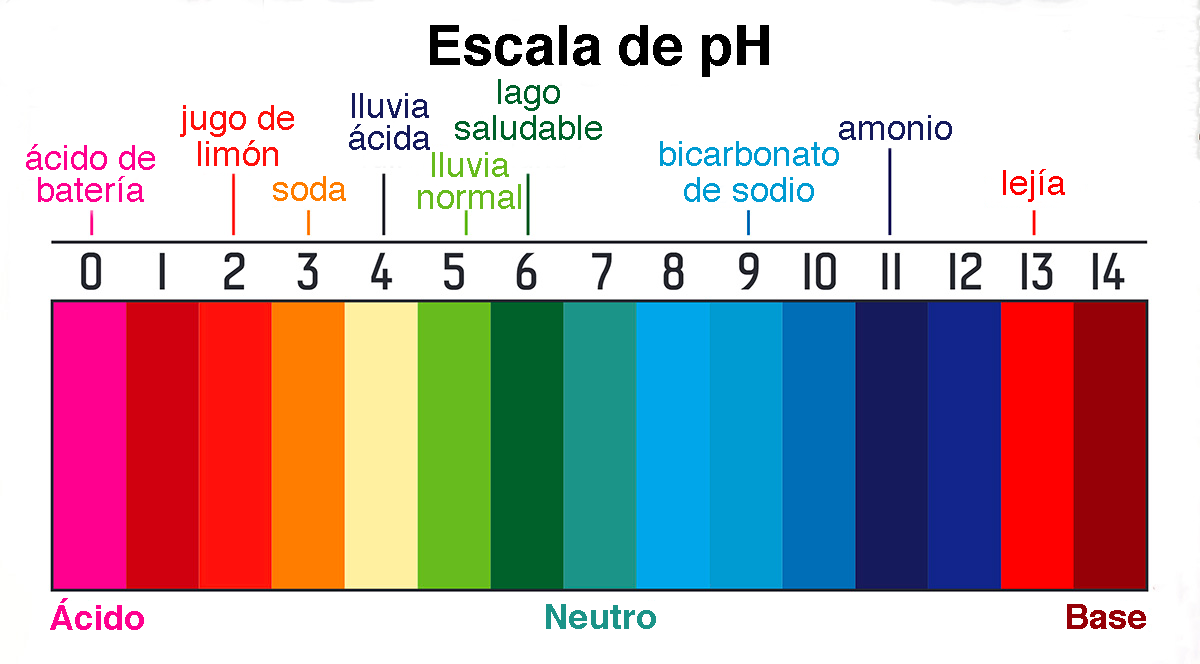
En el agua salada, la electricidad es conducida por iones. Los iones de sodio absorben electrones del terminal negativo, pasándolos a los iones de cloro y luego al terminal positivo, formando un puente que conduce la corriente eléctrica. El agua destilada tiene una conductividad eléctrica muy baja de 0,000055 dS/m (deciSiemens por metro), el agua potable está alrededor de 0,1 a 0,5 dS/ m y el agua de mar alrededor de 44 dS/m. Por tanto, cuanto mayor es la salinidad del agua, es decir, cuanto mayor es la concentración de iones en la solución, mayor es su conductividad eléctrica. La vida, la cual se basa en la química del carbono, requiere un medio líquido para desarrollarse eficazmente. El agua en su estado líquido es el mejor medio para esa química. El agua es necesaria para la disolución de los compuestos químicos que sustentan la vida y para el transporte de nutrientes y desechos. Estos compuestos incluyen sales, azúcares, ácidos, bases y gases como oxígeno y dióxido de carbono. Además, el agua se asocia a las regiones polares de compuestos orgánicos como lípidos, proteínas y ácidos nucleicos. A menudo, estos compuestos forman enlaces de hidrógeno con el agua, que son atracciones débiles entre un protón en una molécula y un átomo electronegativo en la otra. 8. CONCENTRACIÓN DE PROTONES La energía que impulsa los procesos biológicos generalmente se debe a gradientes de concentración de protones en un medio acuoso, a ambos lados de una membrana. Un protón de hidrógeno (H+) es un átomo de hidrógeno al que le falta su electrón. La molécula de agua tiene una capacidad débil para separarse espontáneamente en dos componentes iónicos distintos: (1) el ion hidronio, o catión cargado positivamente (H3O+), que es una molécula de agua con un protón de hidrógeno unido; y (2) el ión hidróxido, o anión con carga negativa (OH-), que es una molécula de agua a la que le falta un protón de hidrógeno, en una fórmula reversible:
En agua pura, las concentraciones de iones hidronio e hidróxido son muy pequeñas e idénticas, siendo cada una de El pH del agua disminuye drásticamente en una solución que contiene grandes cantidades de un ácido fuerte como el ácido clorhídrico (HCl). Las moléculas de HCl donan fácilmente sus protones para aumentar la concentración de iones hidronio, es decir, disminuir el pH de la solución.
Asimismo, el pH del agua aumenta considerablemente en una solución que contiene grandes cantidades de una base fuerte como el hidróxido de sodio (NaOH). Las moléculas de NaOH aceptan fácilmente protones (o donan hidróxidos) para disminuir la concentración de iones hidronio, es decir, aumentar el pH de la solución.
Todos los organismos tienen un rango de pH en el que sus fluidos corporales se mantienen saludables. Los valores de pH demasiado altos o demasiado bajos pueden dañar las células.
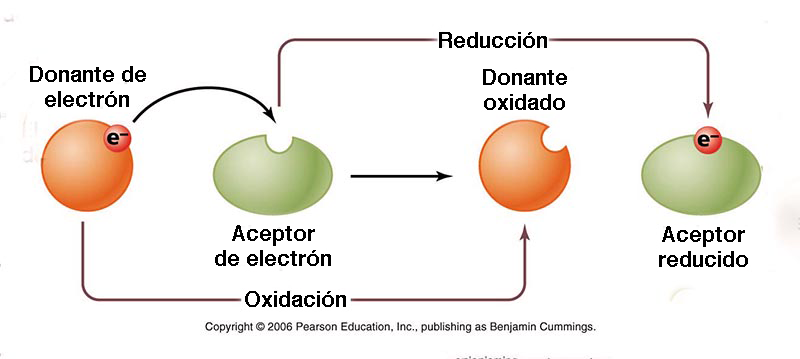
9. CONCENTRACIÓN DE ELECTRONES La concentración de electrones en un medio acuoso es útil para caracterizar las diversas etapas del proceso de oxidación/reducción. Para ello, se utiliza el concepto de potencial redox o potencial de oxidación-reducción (POR). Su complementariedad con el pH en el acondicionamiento de procesos bioquímicos es realmente soprendente. También se denomina E o Eh, o en forma alternativa, como una escala pE correspondiente. El potencial redox es una medida de la afinidad de una sustancia para perder o ganar electrones y, por lo tanto, oxidarse o reducirse, respectivamente (Fig. 17). El estándar es hidrógeno, con potencial redox cero, o E = 0 mv. En agua bien oxidada, con concentraciones de oxígeno disuelto por encima de 1 mg/L, el potencial redox es altamente positivo, por encima de 300-500 mV, y puede alcanzar hasta 800 mV en condiciones de oxidación óptima. En ambientes reducidos, donde falta oxígeno disuelto, el potencial redox es positivo pequeño (cerca de 100 mV) e incluso puede alcanzar valores negativos. Los entornos extremadamente reducidos pueden presentar un potencial redox tan bajo como -400 mV.
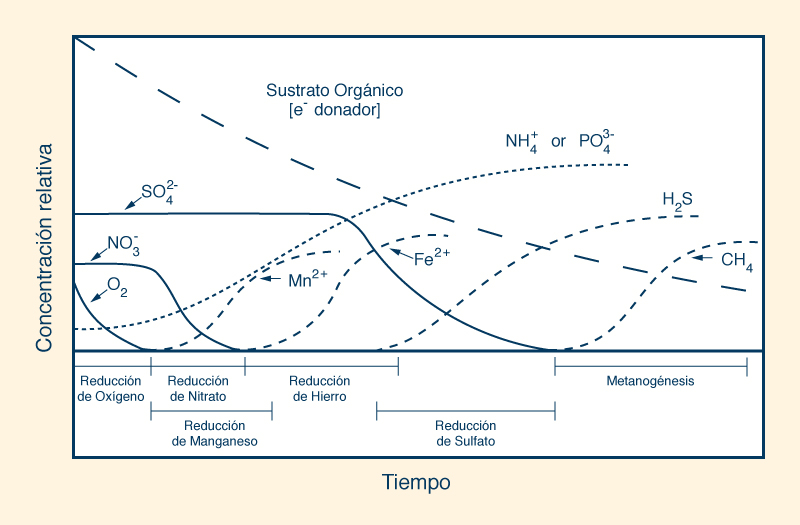
Un valor positivo del potencial redox indica que una sustancia es un agente oxidante; cuanto mayor sea el valor, más oxidante es. Como tal, una solución acuosa con una lectura de +400 mV es cuatro (4) veces más oxidante que una con una lectura de +100 mV. Por el contrario, un valor negativo indica que la solución acuosa es un agente reductor; cuanto menor sea el valor, más reducida será. Por lo tanto, una lectura de -400 mV es cuatro (4) veces más reductora que una lectura de -100 mV. La mayoría de los tipos de agua, incluida el agua potable y el agua embotellada, son agentes oxidantes ya que su valor de potencial redox es positivo. El agua alcalina ionizada es un agente reductor, ya que tiene un valor negativo de potencial redox y es capaz de donar electrones extra para neutralizar los efectos nocivos de los radicales libres en el organismo. Sin embargo, la mayoría de los otros tipos de agua son agentes oxidantes ya que su potencial redox es positivo. En los ecosistemas de humedales, el potencial redox condiciona la secuencia de tiempo de varios tipos de reacciones de oxidación-reducción en un substrato orgánico recién inundado, que van desde la reducción de oxígeno a un potencial redox altamente positivo (E ≅ 800 mv), hasta la metanogénesis, con valores negativos muy bajos (E ≅ -400 mV). La Figura 18 muestra la disminución, con el tiempo, de la concentración relativa de electrones en suelos estacionalmente inundados.
10. CONCLUSIONES Se revisan las propiedades físicas, químicas y biológicas del agua con el objeto de comprender el papel variado de la molécula de agua en el acondicionamiento y apoyo de la vida en la Naturaleza. Se reconoce que las propiedades singulares del agua la hacen muy adecuada para el desarrollo de la química del carbono, ayudando a mantener la vida en todas sus innumerables formas. Por lo tanto, las propiedades del agua abarcan la física, la química y la biología, casi como si la Naturaleza hubiera tenido la intención de que los tres campos se fusionaran en uno solo. Referencias Bibliográficas
Aguilera Mochón, J. A. 2017. El Agua en el Cosmos: La Matriz de la Vida.
RBA Coleccionables, Navarra, Spain.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 221115 |